Костната тъкан има много големи регенеративни способности. В човешкия организъм има само два типа тъкани с по-големи възможности за регенерация - кръвната тъкан и епителът. От гледна точка на оцеляването на огранизма възстановяването на костната тъкан е важен процес - по възможност всяка една фрактурирана или увредена кост трябва да се възстанови най-бързо, за да може човекът или животното да се движат, да си намират храна и да се защитават от врагове. Ето защо в процеса на еволюцията са се изработили механизми на костна регенерация; всеки един зъболекар, който има желание да работи в областта на имплантологията или пародонтологията, трябва да познава тези механизми и да ги направлява в необходимата посока с цел по-добрата успеваемост на лечението. Здравата, устойчива и добре кръвоснабдена костна тъкан е от ключово значение за дългосрочната успеваемост при поставяне на зъбни импланти - тя осигурява стабилно и трайно задържане на импланта и го прави функционално годен. Когато един зъбен имплант е поставен в костни тъкани, настъпва процес на остеоинтеграция и само в рамките на няколко седмици имплантът е на практика част от костта; проблем представлява поставянето на зъбни импланти при недостатъчни по обем костни тъкани, което изисква увеличаване на наличния обем кост - чрез процедури на костна регенерация, костна пластика или костна аугментация.
Ако желаете безплатен преглед и изготвяне на лечебен план за поставяне на зъбни импланти, обадете се на телефон 032 642056 или 0888 646003. Д-р Венцеслав Ралев работи в град Пловдив, град Сливен и град Видин. Нашият екип отговаря и на запитвания по електронна поща на адрес ralev@dentist.bg, ralev_dental@abv.bg и office@ralev-dental.bg.
В областта на ортопедията и травматологията механизмите на костна регенерация са проучени от няколко хиляди години. В общи линии оздравителният процес при фрактури на всяка една кост и на костта на челюстите следват едни и също принципи. Необходимо е да има първична стабилност - първо и най-важно условие. При подвижност на костните фрагменти на една фрактурирана кост заздравяването е трудно и много често е съпроводено с псевдоартрози или остеомиелити от травматичен тип. По същия начин ако един зъб е с патологична подвижност (липсва първична стабилност), няма голям смисъл да се лекуват неговите пародонтални увреждания - прогнозата не е много добра, поне докато зъбът не се шинира към съседни здрави зъби или към остеоинтегрирани зъбни импланти. Ако един имплант не е завинтен здраво в костта, няма и добра прогноза по отношение на костната пластика около него. Рядко и трудно може да се получи добра остеоинтеграция при импланти, които са с нестабилна фиксация в костните тъкани.
Принципите на костната регенерация в пародонтологията и имплантологията също са проучени много отдавна. Въпреки представянето им като нещо крайно сложно, технически трудно за изпълнение и рисково по време на лекции и презентации, в крайна сметка всички тези механизми не са толкова сложни за разбиране. В момента, в който един дентален лекар усвои теоритичната база на костната регенерация, прилагането на тази процедура на практика става въпрос единствено на мануалност, клиничен опит и непрекъснато усъвършенстване. Стремежът на производители и клиницисти е да се разработят оперативни методи, които не са толкова technically sensitive - да не зависят от сръчността на оператора, тъй като различните хора имат различни моторно - двигателни умения и могат да извършват различни по сложност оперативни интервенции. До голяма степен този стремеж е вече реализиран на практика.
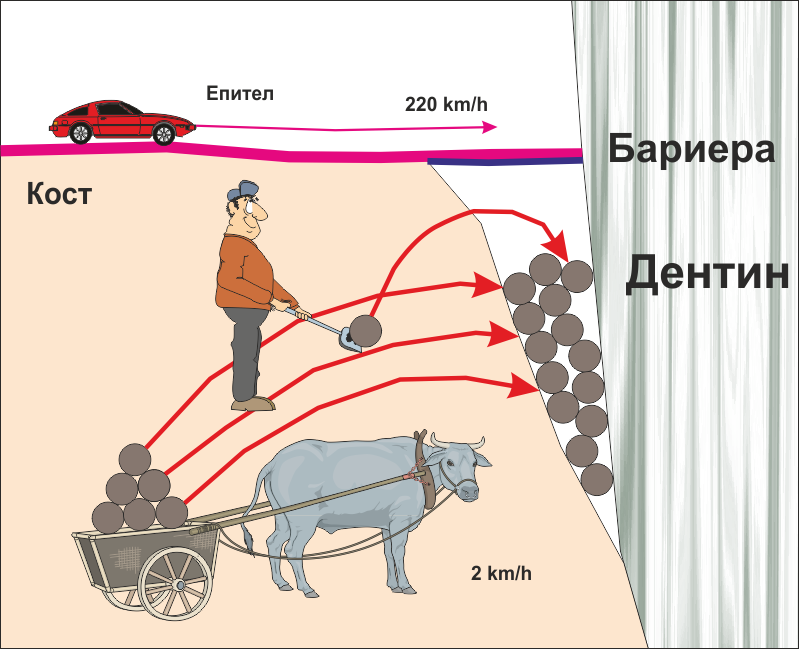
По отношение на костната регенерация има една биологична особеност на организма, която е от ключово значение - епителът има много по-големи възможности за възпроизвеждане, отколкото съединителната тъкан и костта. Причините за това са няколко. На първо място, от гледна точка на защитната функция на епитела е важно той да се самовъзпроизвежда максимално бързо - организмът винаги се стреми да изолира вътрешната си среда от външната, тъй като всяка рана представлява потенциална входна врата за потенциални увреждащи агенти - чисто механични, физични, химични и биологични. На второ място, като огранизация и сложност епителната тъкан е доста по-опростена от съединителната и костната тъкан, при това е и само двуизмерна, а костта трябва да се регенерира в три измерения и в значително по-голям обем. Съответно и най-бързата и съвършенна обмяна не могат да изградят триизмерна плътна тъкан със същата скорост, с която епителизира порезна рана с дължина 4 - 5 милиметра. Порезна рана с такъв размер има срок на оздравителния процес от порядъка на три дни - за този период от време тя се покрива с крусти и само след 14 дни няма и следа от нарушената цялост на организма. Добре зашита оперативна рана в областта на устната кухина позволява сваляне на конците след 7 - 8 дни, а след около 30 дни понякога дори не се открива цикатрикс. В същото време при добра репозиция и фиксация на фрактурните фрагменти единична фрактура заздравява за период от поне 40 дни; при наличие на костен дефект и добре проведена костна пластика заздравителният процес протича в рамките на 4 - 6 месеца.

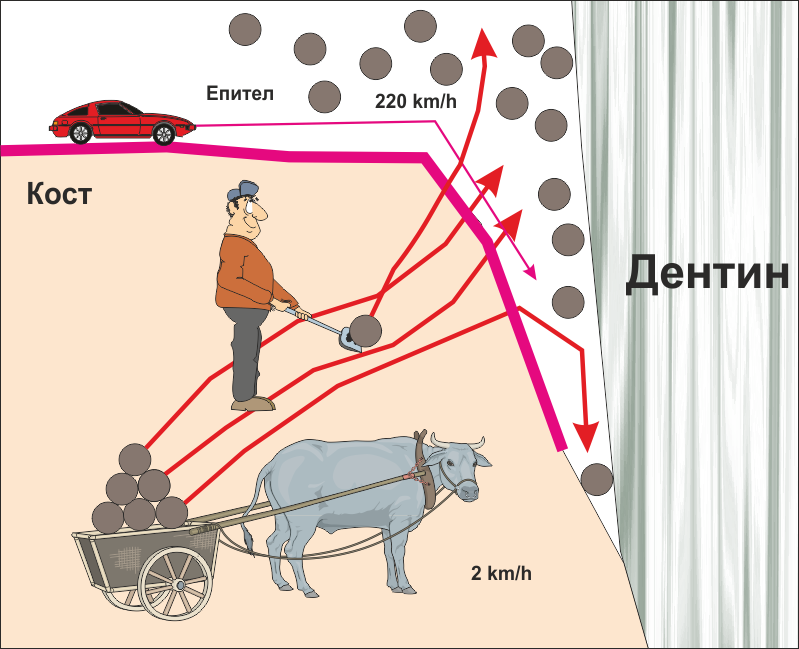
Важно е да се постави бариера между двата вида тъкани - костната тъкан и епитела. Бариерата пречи на епитела да прониква в дълбочина - както вече стана въпрос, скоростта на регенерация на покривната тъкан е в пъти по-голяма от тази на съединителната тъкан. При наличие на открити съединителнотъканни влакна или костна повърхност организмът моментално подава биологични сигнали и епителът бърза да ги покрие. Веднъж покрит с епител, тъканният дефект остава външен по отношение на средата на организма и е невъзможно да се покрие с кост - което и е показано на схемата долу.
Както вече стана въпрос, идеята е да се ограничи костният дефект от епитела. По този начин епителните клетки не проникват в дълбочина, дефектът постепенно се изпълва с фибробласти и остеобласти и се формира фиброзна съединителна тъкан. С течение на времето тя започва да минерализира и осифицира - налице е костна регенерация. През това време епителът се е прикрепил към зъба, в случай че се лекува пародонтален джоб, или към отсрещната повърхност на меките тъкани, в случай че са зашити две ламба едно срещу друго. Бариерата предпазва от проникване на епителни клетки в подлежащите тъкани и колкото по-плътна е тази бариера, толкова по-бързо и в по-голям обем и плътност се образува фиброзна и костна тъкан. Този процес се нарича направлявана тъканна регенерация и в своя класически вид не изисква поставянето на никакъв костозаместващ материал - под бариерната мембрана има единствено празно пространство, но изолирано от външната среда. Видът на бариерната мембрана е от съществено значение - според клиничните наблюдения на нашия екип най-добри са клиничните резултати при употребата на нерезорбируеми мембрани.
В човешкия организъм съществува една мембрана, която е несравнима по своите качества с всичко останало в случай че е необходима костна регенерация. Това е надкостната обвивка, наречена още периост. Тя има силно изразено остеогенетични свойства, които са описани подробно по-долу. Единственият недостатък е че за да се достигне до костния дефект и да се почистят гранулациите там (или да се аплицира изкуствена кост) е необходим оперативен достъп - който почти винаги е свързван със срязване на периоста, което срязване нарушава неговата цялост и съответно има опасност от навлизане на хранително остатъци и микроорганизми през срезната линия. Поради това в последните години има разработени различни видове тунелни техники, при които най-общо през тунелна препарация от отдалечено място се навлиза в областта на тъканния дефект, гранулациите се почистват и през същия отдалечен достъп се поставя необходимото количество изкуствена кост. Тези методи са сигурни и сравнително атравматични като начин на изпълнение, но са технически трудни и приожими само при малки дефекти. Допълнителен полезен ефект на тунелните препарации е доброто изхранване на меките тъкани, които се отделят в много ограничени участъци от подлежащата кост и по този начин не се нарушава кръвоснабдяването им.
В практиката все още намират широко приложение колагеновите мембрани. Те са най-вече с животински произход, макар че напоследък се предлагат и мембрани от синтетичен колаген. Удобен за добив на мембрани е перикардът, като най-често се използва перикард от кон. Колагеновите мембрани осигуряват сравнително добра изолация на оперативното поле, но само в случай че меките тъкани върху тях са зашити плътно; срокът на фрагментиране на колагеновата мембрана е около две седмици, като се разчита че за този период тъканите над мембраната ще епителизират и ще се формира плътен мекотъканен мост, който ще изолира добре подлежащите тъкани. Проблемът е че понякога меките тъкани формират десхисценции (неплътни сраствания с отвори) над костния дефект и тези дехисценции заздравяват доста бавно и трудно. Поради това, както вече стана въпрос, нерезорбируемата мембрана осигурява една доста по-надеждна защита на оперативното поле. Концентираните растежни фактори доста ускоряват процеса на епителизация и като краен резултат осигуряват една по-плътна и стабилна мека тъкан; проблемът с дехсиценциите обаче съществува и при тях. Почистването на оперативната рана в периода трети - петнадесети постоперативен ден донякъде предпазва от дехисценции и също подобрява заздравителния процес; най-добри резултати обаче се получават при комбинация от нерезорбируема мембрана, над която са поставени мембрани от концентирани растежни фактори - поне според клиничния опит на нашия екип.
Както вече стана въпрос, в своя класически вариант направляваната тъкана регенерация не е включвала поставянето на изкуствена кост (или естествена животинска, или човешки остеопластичен материал). В днешно време такъв тип оперативни интервенции се практикуват изключително рядко, тъй като отдавна се установи че поставянето на каквато и да е изкуствена кост драстично подобрява постоперативните резултати. Като краен резултат се получава по-обемна и по-плътна костна тъкан. Освен това заздравителният процес е доста ускорен, тъй като не е необходимо да се синтезира фиброзна съединителна тъкан с последваща минерализация - минералните субстанции са налични в състава на костозаместващия материал и те просто се интегрират към естествената костна тъкан на организма. Това тяхно свойство се нарича остеокондуктивност. При някои по-нови поколения материали има и остеоиндуктивност - това е способността на материала да индуцира синтеза на нова костна тъкан в участъци, в които тя изобщо липсва. Остеоиндуктивността е най-изразена при костните морфогенетични протеини и в много малък обем - при лиофилизираната човешка кост.
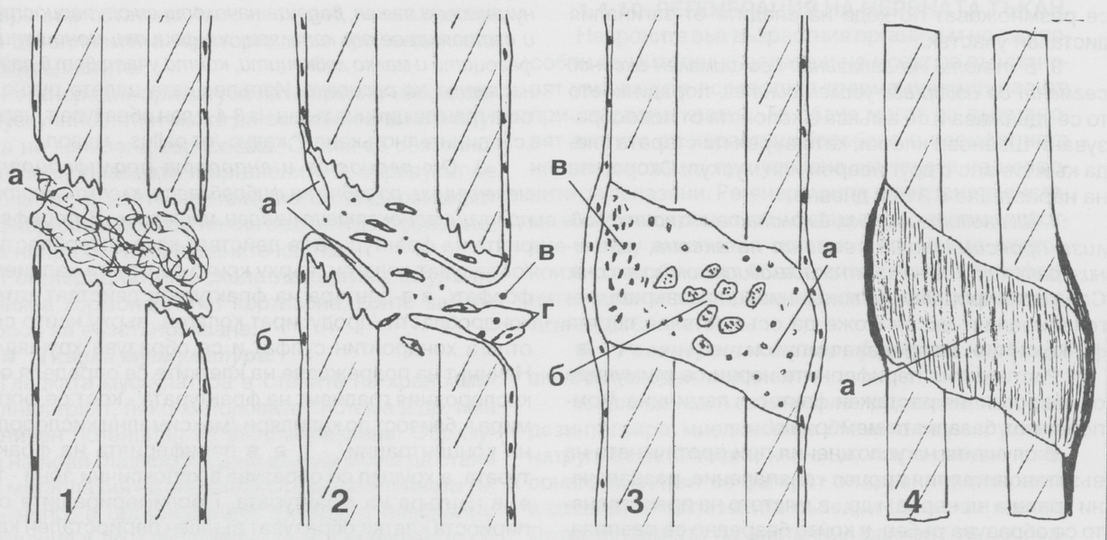
Заздравителният процес при фрактури на костните тъкани е показан на горната схема. Необходимо е той да се познава в детайли от всеки дентален лекар, който има амбицията да се развива в областта на имплантологията, тъй като оздравителните процеси протичат по сходен механизъм независимо дали някъде в организма има фрактурирана кост или трябва да се изгради костен обем с цел осигуряване на задръжката на зъбен имплант. Процесът на костна регенерация протича в няколко последователни стадия: във фаза 1 в зоната на фрактурата се излива кръв от разкъсаните кръвоносни съдове и се образува съсирек, изпълващ пространството между костните фрагменти - на горната схема коагулумът е означен с буквата а. След това в съсирека започва да прораства гранулационна тъкан, водеща началото си от периоста и състояща се от капиляри, лимфоцити, моноцити и известно количество фагоцити, които участват в разнасянето на съсирека. Организацията на кръвния коагулум е процес от ключово значение за безпроблемното протичане на остеогенезата и ако на този етап отнякъде навлязат инфекциозни агенти, просто няма да има правилен оздравителен процес. Изпълващата цялата пукнатина гранулационна тъкан в рамките на три или четири дни образува така наречения съединителнотъканен калус (от латински callus - мазол) - на схемата горе това е показано на фаза 2. Капилярите са означени с а, периостът - с б, моноцитите с в, а мезенхимните клетки с г. От периоста и ендооста пролиферират недиференцирани мезенхимни клетки, които наподобяват фибробласти и продуцират екстрацелуларен материал - фаза 3. В периферната част на фрактурата (или зоната на костна пластика) тези клетки действат като остеобласти и образуват колаген, върху който започва отлагането на различни неорганични субстанции - основно калциев фосфат. В центъра на фрактурата клетките действат като хондробласти (хрущялообразуващи клетки) - също продуцират колаген, върху който се отлага хондроитинсулфат - така постепенно се образува хрущялна тъкан.
Начинът на подреждане на клетките се определя от кислородния градиент в областта на дефекта - кост се формира близо до капилярите при висока кислородна концентрация, а хрущял се формира в хипоксичните зони - т.е. в центъра на костния дефект. Пролифериращите от периоста клетки образуват външен периостален калус (бандаж от реактивна тъкан), който имобилизира фрактурата и заедно със съседните мускули и кръвоносни съдове подпомага оздравителния процес. На горната схема това е показано във фаза 3 - с буквата а е означен прокалусът, който в центъра е изграден от хрущял (б), а периферията - от кост (в). Периостът играе изключително важна роля във всеки един процес на остеогенеза, поради което неговите възможности трябва да се използват в максимална степен. Вътрешната камбиална повърхност на периоста излъчва остеобласти, костни морфогенетични протеини и различни други фактори, които стимулират остеогенезата; ето защо е важно да не се изолира периостът от пространството, в което се очаква да се образува нова кост. Фрактурите оздравяват на около 70 - 80 % по периостален път и едва на около 20 - 30 % по ендоосален път; това обаче важи предимно за млади хора, на възраст от 20 - 30 години по литературни данни. При пациенти на възраст 60 - 70 години оздравителният процес се дължи приблизително на 50 % на възстановителните процеси на периоста и на още 50 % на тези на ендооста.
Хрущялното вещество се вижда на седмия ден след фрактурата под формата на островчета сред съединителната тъкан. Това е временният калус; около 14 дни след травмата пролифериращите остеобласти започват да синтезират остеоид, образуващ протеиновия матрикс на костта. Сред прокалуса се формира безразборна мрежа от остеоидни трабекули, които започват да се импрегнират с неорганични съединения. По този начин хрущялният калус се замества от костен калус. Костните фрагменти са здраво свързани, но образуваното костно вещество е в излишък. Около 4 - 6 седмици след травмата то започва да се ремоделира. Резорбцията му се осъществява от остеокластите, като едновременно с това се изгражда нова кост от остеокластите - образува се окончателният калус. След статично натоварване се довършва преустройството на костта, появява се костен мозък, развива се васкуларизация и инервация и настъпва пълно възстановяване. Образуваният в центъра хрущял се дезинтегрира по следния начин - хрущялните клетки продуцират алкална фосфатаза, която предизвиква калцификация на заобикалящото ги вещество. По този начин те се погребват в своеобразни пещери без достъп на кислород и хранителни вещества и постепенно отмират. По същия начин се дезинтегрира и продуцираното от клетките екстрацелуларно вещество. В разградения хрущял прорастват капиляри и остеобласти, които идват от периферията, при което постепенно се замества от здрава костна тъкан. Някои неблагоприятни условия могат да забавят оздравителния процес при фрактури. Липсата на адекватна имобилизация (много често при клавикула и ребра, но понякога и при долна челюст) води до заместване на съединителнотъканния калус от плътна съединителна тъкан, а не от кост, която съединителна тъкан пречи на по-нататъшното възстановяване. Поради това осигуряването на първична стабилност на фрактурните фрагменти е от ключово значение за протичането на нормалния оздравителен процес при счупени кости. При наличието на инфекция костните остатъци поддържат възпалението, което от своя страна забавя регенерацията. Ако краищата на фрактурата са раздалечени един от друг, те остават подвижни, костно - ставният калус не се диференцира в костен и се образува лъжлива става - псевдоартроза. Добрата връзка с околните тъкани (мускули, кръвоносни съдове и сухожилия) е предпоставка за по-бързото и сигурно протичане на оздравителния процес. При наличие дори и на минимална подвижност на фрагментите се влошават условията за нормален оздравителен процес - при всяко движение синтезираният колаген се разкъсва и не се получава свързване на съединителната тъкан; капилярите също се разкъсват и се излива плазма в междутъканните пространства, което допълнително дразни тъканите и по този начин свързването на фрагмените се забавя.
Ако е налице свръхпродукция на костна тъкан, се образуват екзостози, а при по-голямо разрастване на хрущял над фрактурната линия се наблюдават енхондрални осификации. Понякога се наблюдават различни реактивно - пролиферативни процеси в областта на регенерация - спикулите например са израстъци, подобни на бодли на таралеж, които силно дразнят меките тъкани и изискват допълнителни хирургични корекции. Недостатъчното набавяне на витамин С и Д с храната също влияе неблагоприятно върху оздравителния процес при фрактури. При такъв хранителен режим се подтиска синтезата на колаген. Неблагоприятни фактори са и недостатъчното количество калциеви соли, йонизиращите лъчения и локалните нарушения в кръвоснабдяването. Особено опасни са йонизиращите лъчения, които се прилагат като лъчелечение на неопластични процеси - те водят до така наречената остеорадионекроза, която е силно болезнена и изисква тежко и продължително лечение.
При фрактури на големите кости в резултат на кръвоизливи могат да се наблюдават усложнения от типа на хиповолемичния шок. Тежко усложнение е мастната емболия, която се получава при попадане на мастна тъкан в кръвния ток. Такива усложнения обаче рядко се развиват при фрактури на челюстните кости - те се налюдават най-вече при счупвания на бедрената кост. В регулацията на костното зарастване участват интерлевкин 1, епидермалният и тромбоцитният растежен фактор. Остеобластите имат доказани рецептори и за трансформиращия растежен фактор алфа, както и за макрофагеалните растежни фактори. Поради добрите ефекти на тромбоцитните растежни фактори в последните няколко години при костната регенерация намира все по-голямо приложение богата на тромбоцити плазма и още повече - концентрираните растежни фактори.
Механизъм на капилярогенезата. Прорастването на капиляри в зоната, в която ще се осъществява костната регенерация, е важно условие за бързото и безпроблемно протичане на процеса. Като златен стандарт се приема автогенното костното блокче, взето от отдалечено място в организма - в него бързо прорастват капиляри с линейна скорост от около един милиметър на ден. Това обаче се случва само до линеен размер от около 7 см. на трансплантата - над този размер силно нараства опасността от некроза и е необходим трансплантат с микросъдова анастомоза. Доста по-различна е ситуацията при поставяне на изкуствена кост - в нея също прорастват капиляри, но със значително по-малка скорост. Размесването на остеопластичния материал с автогенен фибрин и растежни фактори значително ускорява процеса на резорбцията на материала и в особено силна степен - ангиогенезата, като по литературни данни за около 3 месеца след поставяне на такава смес се стига до формирането на здрава, добре васкуларизирана кост. Напоследък този материал се нарича лепкава кост (sticky bone), тъй като има добра адхезия към мястото на апликацията си, а и автогенният фибрин добре залепва частиците на костта.
Всички процеси на регенерация изискват осигуряване на първична стабилност. Това е вторият ключов фактор за успеваемостта на костната пластика - имобилизаицята на графта.